Лекарственные средства на основе бензола
Содержание:
- Функции кислот
- Статья составлена с использованием следующих материалов:
- История
- Страницы
- Указанный состав ингредиентов шампуня
- Benzoic acid в косметике и медицине
- целебный
- Реакции
- Применение
- Структурная изомерия
- Химические свойства карбоновых кислот
- Действие на вредные организмы
- Соли бензойной кислоты
- Применение
- Credits
- Опасность
- Реакции
- приложений
Функции кислот
Кислоты в косметических средствах выполняют разные функции. Молочная отшелушивает ороговевшие чешуйки, придавая коже гладкость и мягкость. Лимонная отбеливает, натуральные АНА и ВНА увлажняют. Органические кислоты для сохранности продукта сочетают с консервантами. Чем ниже значение ph (показатель кислотности), тем больше срок использования крема.
Чего ожидать от крема или шампуня, у которого в составе есть benzoic acid? В косметике он выполняет роль консерванта. Известно, что бензойная кислота содержится в ягодах брусники. Именно ей знаменитая ягода обязана свойством воздействовать на инфекцию в почках. Она же образуется в кисломолочных ферментированных продуктах.
На этом основании синтетическую бензойную кислоту применяют в производстве натуральных средств для кожи. Некоторые марки спокойно указывают ее в составе, не боясь укоров в недобросовестности.
Технологи объясняют это двумя причинами: во-первых, использовать ценное органическое сырье на производство консервантов расточительно, его забирает пищевая промышленность.
Во-вторых, бензойная кислота и ее производное Sodium Benzoate (Е211) разрешены экостандартами и поэтому считаются органическими консервантами. В последнее время больше внимания уделяют Е211, поскольку он, в отличие от Е210, не проникает через мембрану клетки.
Статья составлена с использованием следующих материалов:
Апасов И.В., Фоменко Г.К. Эффективность препаратов для повышения сохранности сахарной свеклы при хранении. Журнал «Сахар» №4, 2011 год, с. 37-39
2.
Бердников А.С., Сапронов Н.М. Хранение сахарной свеклы современных гибридов с применением полифункциональных препаратов. Материалы всероссийской научно-практической конференции «Аграрная наука – сельскому хозяйству» 27-28 января 2009 г. Курская государственная сельско-хозяйственная академия им. И.И. Иванова. – Курск, 2009. ч.4. с 39-41
3.
Буклет «Кагатник», ЗАО «Щелково Агрохим», Россия
4.
Государственный каталог пестицидов и агрохимикатов, разрешенных к применению на территории Российской Федерации, 2013 год. Министерство сельского хозяйства Российской Федерации (Минсельхоз России)
5.Кнунянц И.Л. Химическая энциклопедия: В 5 т./Ред. кол. Кнунянц И.Л. (гл. ред.) и др. – М.: Советская энциклопедия. 1988.
Свернуть
Список всех источников
История
Впервые бензолсодержащие смеси, образующиеся в результате перегонки каменноугольной смолы, описал немецкий химик Иоганн Глаубер в книге Furni novi philosophici, опубликованной в 1651 году. Бензол как индивидуальное вещество был описан Майклом Фарадеем, выделившим это вещество в 1825 году из конденсата светильного газа, получаемого коксованием угля. Вскоре, в 1833 году, получил бензол — при сухой перегонке кальциевой соли бензойной кислоты — и немецкий физико-химик Эйльгард Мичерлих. Именно после этого получения вещество стали называть бензолом.
К 1860-м годам было известно, что соотношение количества атомов углерода и атомов водорода в молекуле бензола аналогично таковому у ацетилена, и эмпирическая формула их — CnHn. Изучением бензола серьёзно занялся немецкий химик Фридрих Август Кекуле, которому в 1865 году и удалось предложить правильную — циклическую формулу этого соединения. Известна история о том, что Ф. Кекуле представлял в своём воображении бензол в виде змеи из шести атомов углерода. Идея же о цикличности соединения пришла ему во сне, когда воображаемая змея укусила себя за хвост. Фридриху Кекуле удалось в то время наиболее полно описать свойства бензола.
Страницы
- Главная страница
- ОСНОВЫ ОБЩЕЙ ХИМИИ
- 1.1 Важнейшие классы неорганических веществ
- 2.1 Вещества. Атомы
- 2.2 Размеры атомов
- 2.3 Молекулы. Химические формулы
- 2.4 Простые и сложные вещества
- 2.5 Валентность элементов
- 2.6 Моль. Молярная масса
- 2.7 Закон Авогадро
- 2.8 Закон сохранения массы веществ
- 2.9 Вывод химических формул
- 3.1 Строение атома. Химическая связь
- 3.2 Строение атома
- 3.4 Строение электронной оболочки атома
- 3.5 Периодическая система химических элементов
- 3.6 Зависимость свойств элементов
- 3.7 Химическая связь и строение вещества
- 3.8 Гибридизация орбиталей
- 3.9 Донорно-акцепторный механизм образования
- 3.10 Степени окисления элементов
- 4.1 Классификация химических реакций
- 4.2 Тепловые эффекты реакций
- 4.3 Скорость химических реакций
- 4.4 Необратимые и обратимые реакции
- 4.5 Общая классификация химических реакций
- НЕОРГАНИЧЕСКАЯ ХИМИЯ
- 5.1 Растворы. Электролитическая диссоциация
- 5.2 Количественная характеристика состава растворов
- 5.3 Электролитическая диссоциация
- 5.4 Диссоциация кислот, оснований и солей
- 5.5 Диссоциация воды
- 5.6 Реакции обмена в водных растворах электролитов
- 5.7 Гидролиз солей
- 6.1 Важнейшие классы неорганических веществ
- 6.2 Кислоты, их свойства и получение
- 6.3 Амфотерные гидроксиды
- 6.4 Соли, их свойства и получение
- 6.5 Генетическая связь между важнейшими классами
- 6.6 Понятие о двойных солях
- 7.1 Металлы и их соединения
- 7.2 Электролиз
- 7.3 Общая характеристика металлов
- 7.4 Металлы главных подгрупп I и II групп
- 7.5 Алюминий
- 7.6 Железо
- 7.7 Хром
- 7.8 Важнейшие соединения марганца и меди
- 8.1 Неметаллы и их неорганические соединения
- 8.2 Водород, его получение
- 8.3 Галогены. Хлор
- 8.4 Халькогены. Кислород
- 8.5 Сера и ее важнейшие соединения
- 8.6 Азот. Аммиак. Соли аммония
- 8.7 Оксиды азота. Азотная кислота
- 8.8 Фосфор и его соединения
- 8.9 Углерод и его важнейшие соединения
- 8.10 Кремний и его важнейшие соединения
- ОРГАНИЧЕСКАЯ ХИМИЯ
- 9.1 Основные положения органической химии. Углеводороды
- 9.2 Электронные эффекты заместителей в органических соединениях
- 9.3 Предельные углеводороды (алканы)
- 9.3.1 Насыщенные УВ. Метан
- 9.4 Понятие о циклоалканах
- 9.5 Непредельные углеводороды
- 9.6 Диеновые углеводороды (алкадиены)
- 9.7 Алкины
- 9.8 Ароматические углеводороды
- 9.9 Природные источники углеводородов
- 10.1 Кислородсодержащие органические соединения
- 10.2 Фенолы
- 10.3 Альдегиды
- 10.4 Карбоновые кислоты
- 10.5 Сложные эфиры. Жиры
- 10.6 Понятие о поверхностно-активных веществах
- 10.7 Углеводы
- 11.1 Амины. Аминокислоты
- 11.2 Белки
- 11.3 Понятие о гетероциклических соединениях
- 11.4 Нуклеиновые кислоты
- 12.1 Высокомолекулярные соединения
- 12.2 Синтетические волокна
Указанный состав ингредиентов шампуня
Хорошо еще, если производитель честно указывает химический состав шампуня на упаковке. Тогда мы, купив шампунь, отдаем себе отчет — насколько безопасно мыть этим шампунем волосы. Но иногда на упаковке пишут: консерванты, отдушки и т. д., без указания химических названий и формул. За такими словами могут скрываться любые опасные для здоровья вещества. Если у человека есть склонность к аллергическим реакциям, он может моментально ощутить на себе действие аллергена. В других случаях вредные вещества из шампуня могут накапливаться в организме и вызывать кожные заболевания или гормональные нарушения. Люди ходят по врачам, лечатся месяцами, но не связывают заболевание с появлением нового шампуня.
Некоторые вредные вещества могут быть получены из растительных компонентов. Шампуни с подобными веществами могут считаться натуральными, органическими и экологически чистыми, но также наносить вред нашему здоровью.

Давайте разберемся, какими вредными веществами чаще всего злоупотребляют производители шампуней, чтобы угодить неразборчивому потребителю и побыстрей получить выгоду.
Benzoic acid в косметике и медицине
Существуют случаи, когда присутствие бензойной кислоты в составе кремов оправдано. Более того, она является действующим веществом. Эти продукты, как правило, профессиональные, имеют строгую рекомендацию к употреблению и должны применяться под надзором специалистов. Время выдержки на коже минимальное. Возможны покраснения, ощущения покалывания или пощипывания.
Бензойная кислота относится к слабым кератолитикам. Превышение концентрации или допустимого времени воздействия приведет к химическому ожогу. Поэтому некоторые кремы наносят очагово, точечно. Это скорее не косметика, а лекарство.
К таким продуктам относятся мази от чесотки, антигрибковые кремы, противокашлевые микстуры, средства для борьбы с акне, лаки для волос сильной фиксации, пилинги, средства для удаления веснушек.
целебный
-Это компонент мази Уитфилда, которая используется для лечения кожных заболеваний, вызванных грибками, такими как стригущий лишай и микоз. Мазь Уитфилда состоит из 6% бензойной кислоты и 3% салициловой кислоты.
-Это ингредиент в настойке бензоина, который использовался в качестве местного антисептика и противоотечного ингаляционного средства. Бензойная кислота использовалась как отхаркивающее, болеутоляющее и антисептическое средство до начала 20 века.
-Бензойная кислота использовалась в экспериментальной терапии пациентов с заболеваниями, связанными с накоплением остаточного азота.
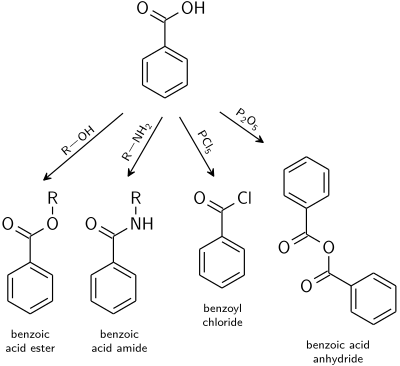
Реакции
Реакции бензойной кислоты могут протекать либо по ароматическому кольцу, либо по карбоксильной группе .
Ароматическое кольцо
Реакция электрофильного ароматического замещения будет происходить в основном в 3-м положении из-за электроноакцепторной карбоксильной группы ; т.е. бензойная кислота является .
Карбоксильная группа
Реакции, характерные для карбоновых кислот, распространяются и на бензойную кислоту.
- Бензоатные эфиры являются продуктом катализируемой кислотой реакции со спиртами .
- Амиды бензойной кислоты обычно получают из бензоилхлорида .
- Дегидратацию до бензойного ангидрида индуцируют уксусным ангидридом или пентоксидом фосфора .
- Производные кислот с высокой реакционной способностью, такие как галогенангидриды , легко получить путем смешивания с галогенирующими агентами, такими как хлориды фосфора или тионилхлорид .
- Ортоэфиры могут быть получены реакцией спиртов в кислых безводных условиях с бензонитрилом .
- Восстановление до бензальдегида и бензилового спирта возможно с использованием DIBAL-H , LiAlH 4 или боргидрида натрия .
- Декарбоксилирование до бензола можно осуществить нагреванием в хинолине в присутствии солей меди. Декарбоксилирование Хунсдикера может быть достигнуто путем нагревания соли серебра.
Применение
Калориметрия
Бензойная кислота используется как вещество в качестве теплового стандарта для калибровки калориметров по температуре и теплоёмкости, так как теплота кристаллизации и плавления хорошо известны и воспроизводимы.
Сырьё
Бензойная кислота служит для получения многих реактивов, наиболее значимые из них:
Бензоилхлорид, C6H5C(O)Cl, получается обработкой бензойной кислоты тионилхлоридом, фосгеном или хлоридами фосфора PCl3 и PCl5
C6H5C(O)Cl — важное исходное вещество для некоторых производных бензойной кислоты, таких как бензилбензоат, используемый как искусственный ароматизатор и репеллент.
Бензоатные пластификаторы, такие как гликоль-, диэтиленгликоль- и триэтиленгликолевые эфиры, получаемые переэтерефикацией метилбензоата с соответствующим диолом. Альтернативно эти вещества получаются действием бензоилхлорида на соответствующий диол
Эти пластификаторы используются с соответствующими эфирами терефталевой кислоты.
Фенол, C6H5OH, получаемый окислительным декарбоксилированием при 300—400 °C. Необходимая температура может быть понижена до 200 °C добавлением каталитических количеств солей меди (II). Далее фенол может быть конвертирован в циклогексанол, который служит исходным веществом в синтезе нейлона.
Консервант
Бензойную кислоту и её соли используют при консервировании пищевых продуктов (пищевые добавки E210, E211, E212, E213).
Бензойная кислота, блокируя ферменты, замедляет обмен веществ во многих одноклеточных микроорганизмах и грибках. Она подавляет рост плесени, дрожжей и некоторых бактерий.
В пищевые продукты её добавляют в чистом виде или в виде натриевой, калиевой или кальциевой соли.
Губительное действие на микрофлору начинается с абсорбции бензойной кислоты липидной стенкой клетки.
Поскольку через стенку клетки может проникнуть только недиссоциированная кислота, бензойная кислота проявляет антимикробное действие только в кислых пищевых продуктах.
Если внутриклеточный pH 5 или меньше, анаэробная ферментация глюкозы через фосфорфруктокиназу уменьшается на 95 %. Эффективность бензойной кислоты и бензоатов зависит от кислотности (pH) пищи.
Кислая пища, напитки, такие, как фруктовые соки, (содержащие лимонную кислоту), газированные напитки, содержащие в растворе (углекислый газ), безалкогольные напитки с (фосфорной кислотой), соленья (молочная кислота) и другие кислые пищевые продукты консервируются бензойной кислотой и её солями.
Принятые и оптимальные концентрации бензойной кислоты при консервации пищи 0,05—0,1 %.
Медицина
Бензойную кислоту применяют в медицине при кожных заболеваниях, как наружное антисептическое (противомикробное) и фунгицидное (противогрибковое) средства, при трихофитиях и микозах, а её натриевую соль, — бензоат натрия — как отхаркивающее средство.
Другие применения
Эфиры бензойной кислоты (со спиртами от метилового до амилового) обладают сильным и приятным запахом и применяются в парфюмерной промышленности.
Некоторые другие производные бензойной кислоты, такие как, например, хлор- и нитробензойные кислоты, широко применяются для синтеза красителей.
Структурная изомерия
Для предельных карбоновых кислот характерна структурная изомерия – изомерия углеродного скелета и межклассовая изомерия.
Структурные изомеры – это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета характерна для карбоновых кислот, которые содержат не менее четырех атомов углерода.
| Например. Формуле С4Н8О2 соответствуют бутановая и 2-метилпропановая кислота |
| Бутановая (масляная) кислота | Изомасляная (2-метилпропановая) кислота |
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Карбоновые кислоты изомерны сложным эфирам. Общая формула и спиртов, и простых эфиров — CnH2nО2.
| Например. Межклассовые изомеры с общей формулой С2Н4О2: уксусная кислота СН3–CОOH и метилформиат H–COOCH3 |
| Уксусная кислота | Метиловый эфир муравьиной кислоты |
| СН3–CОOH | HCOOCH3 |
Общую формулу СnH2nO2 могут также иметь многие другие полифункциональные соединения, например: альдегидоспирты, непредельные диолы, циклические простые диэфиры и т.п.
Химические свойства карбоновых кислот
.
Для карбоновых кислот характерны следующие свойства:
|
1. Кислотные свойства
| Кислотные свойства карбоновых кислот возникают из-за смещения электронной плотности к карбонильному атому кислорода и вызванной этим дополнительной (по сравнению со спиртами и фенолами) поляризацией связи О–Н. |
|
Карбоновые кислоты – кислоты средней силы.
В водном растворе карбоновые кислоты частично диссоциируют на ионы: R–COOH ⇆ R-COO– + H+ |
1.1. Взаимодействие с основаниями
Карбоновые кислоты реагируют с большинством оснований. При взаимодействии карбоновых кислот с основаниями образуются соли карбоновых кислот и вода.
CH3COOH + NaOH = CH3COONa + H2O
Карбоновые кислоты реагируют с щелочами, амфотерными гидроксидами, водным раствором аммиака и нерастворимыми основаниями.
| Например, уксусная кислота растворяет осадок гидроксида меди (II) |
| Например, уксусная кислота реагирует с водным раствором аммиака с образованием ацетата аммония |
CH3COOH + NH3 = CH3COONH4
1.2. Взаимодействие с металлами
Карбоновые кислоты реагируют с активными металлами. При взаимодействии карбоновых кислот с металлами образуются соли карбоновых кислот и водород.
| Например, уксусная кислота взаимодействует с кальцием с образованием ацетата кальция и водорода. |
1.3. Взаимодействие с основными оксидами
Карбоновые кислоты реагируют с основными оксидами с образованием солей карбоновых кислот и воды.
| Например, уксусная кислота взаимодействует с оксидом бария с образованием ацетата бария и воды. |
| Например, уксусная кислота реагирует с оксидом меди (II) |
2СН3СООН + CuO = H2О + ( CH3COO)2 Cu
1.4. Взаимодействие с с солями более слабых и летучих (или нерастворимых) кислот
Карбоновые кислоты реагируют с солями более слабых, нерастворимых и летучих кислот.
| Например, уксусная кислота растворяет карбонат кальция |
| Качественная реакция на карбоновые кислоты: взаимодействие с содой (гидрокарбонатом натрия) или другими гидрокарбонатами. В результате наблюдается выделение углекислого газа |
Действие на вредные организмы
Бензойная кислота оказывает сильное угнетающее действие на плесневые грибы, бактерии и дрожжи, в частности, обладает значительным эффектом обеззараживания по слизеобразующим мезофиллам и плесневым грибам.
Помимо дезинфицирующих свойств, вещество тормозит физиологические процессы, в частности, интенсивность дыхания и прорастания урожая свеклы. За счет снижения интенсивности дыхания уменьшается количество проросших и загнивших корнеплодов свеклы. По данным из литературных источников, препарат Кагатник способствует уменьшению интенсивности дыхания на 12 мг СО2/г•ч (или на 24%).
Защитное действие препарата продолжается 90-120 дней.
Температурный оптимум Кагатника находится в диапазоне от 0 до 5 °С, т.е. полностью совпадает с наилучшей температурой для хранения корнеплодов свеклы. При ее повышении препарат полностью сохраняет свое антисептическое действие, поскольку отдельные углеводороды, входящие в его состав, переходят в газообразное состояние и действуют на микромицеты более активно. Однако из-за интенсивной диссоциации действующих веществ целесообразно повышение концентрации препарата при формировании кагата.
Механизм действия. Препарат «Кагатник» на основе бензойной кислоты имеет отличный от других фунгицидов механизм действия: он подавляет в клетках активность ферментов, которые расщепляют сахара, а также ферментов, отвечающих за окислительно-восстановительные реакции.
Как указывалось выше, карбоциклические углеводороды действуют не только на патогенную микрофлору, но и на корнеплоды, минимизируя интенсивность дыхания последних за счет интенсивной суберинизации поврежденных паренхимных тканей.
Соли бензойной кислоты
Рассмотрим какие бывают бензоаты, их свойства и применение:
- Бензоат аммония. Представляет собой неорганическое соединение бензойной кислоты и соли аммония. Не имеет цвета, хорошо растворяется в этаноле, воде. Структурная формула – NH4(C6H5COO). Используется как антисептик (предупреждает процессы разложения на поверхности открытых ран), консервант в пищевой промышленности для увеличения срока годности продуктов, стабилизатора при изготовлении клеев, латексов и ингибитора коррозии.
- Бензоат лития. Это белая кристаллическая соль лития и бензойной кислоты. Химическая формула соединения – C6H5 – COOLi. Имеет сладковатый вкус, без запаха, растворяется в воде. Используется в фармакологии как нормотимическое средство для нормализации психического состояния. Оказывает антиманиакальное, седативное, антидепрессивное действие. Данный эффект обусловлен тем, что ионы лития вытесняют из клеток ионы натрия, снижая биоэлектрическую активность нейронов мозга. В результате падает уровень серотонина в тканях, концентрация норэпинефрина, повышается чувствительность нейронов гиппокампа к действию допамина. В терапевтических концентрациях снижает концентрацию нейронального инозита и блокирует активность инозил –1–фосфатазы.
- Бензоат натрия. Выступает пищевой добавкой, зафиксирована под кодом Е211, относится к группе консервантов. Структурная формула – C6H5COONa. Натриевая соль бензойной кислоты имеет характерный неярко выраженный запах бензальдегида, белый цвет. Консервант угнетает рост плесневых грибов, включая афлатоксинобразующие, дрожжей и снижает активность ферментов, расщепляющих крахмал, триглицериды.
Лучшие материалы месяца
- Коронавирусы: SARS-CoV-2 (COVID-19)
- Антибиотики для профилактики и лечения COVID-19: на сколько эффективны
- Самые распространенные «офисные» болезни
- Убивает ли водка коронавирус
- Как остаться живым на наших дорогах?
В натуральных продуктах бензоат натрия содержится в яблоках, горчице, изюме, клюкве, корице. Применяется для консервирования плодово-ягодных, рыбных, мясных изделий, сладких газированных напитков. Входит в состав отхаркивающих средств, косметической продукции.
Помните, бензоат натрия может нарушать область ДНК в митохондриях и вызывать нейродегенеративные заболевания, болезнь Паркинсона, цирроз печени. Поэтому применение добавки Е211, из-за небезопасности для здоровья человека, в последние годы стремительно сокращается.
Таким образом, бензойная кислота и ее соли – органические добавки, используемые в пищевой, фармакологической, авиационной промышленностях и косметологии в качестве консерванта. Для сохранения здоровья употреблять продукты, содержащие Е210, нужно строго в умеренном количестве. Безопасная доза составляет 5 мг вещества на килограмм веса. Иначе перенасыщение организма бензойной кислотой может вызвать аллергические реакции, поражение нервной системы.
Больше свежей и актуальной информации о здоровье на нашем канале в Telegram. Подписывайтесь: https://t.me/foodandhealthru
Автор статьи:
Тедеева Мадина Елкановна
Специальность: терапевт, врач-рентгенолог, диетолог.
Общий стаж: 20 лет.
Место работы: ООО “СЛ Медикал Груп” г. Майкоп.
Образование: 1990-1996, Северо-Осетинская государственная медицинская академия.
Другие статьи автора
Будем признательны, если воспользуетесь кнопочками:
Применение
Зарегистрированные препараты на основе бензойной кислоты разрешены к применению против болезней cвеклы сахарной (кагатные гнили).
В результате проведенных производственных испытаний установлено положительное влияние препарата на сохранность корнеплодов сахарной свеклы в условиях открытых кагатов. Выявлено, что после 20 и 40 суток хранения сырья содержание гнилой массы в среднем составило на контроле 1,85 и 3,0% – 0,9 и 1,6% к массе свеклы.
Применение препарата с рациональной нормой расхода жидкости способствовало снижению загнивания корнеплодов в сравнении с контрольным вариантом в среднем на 48,4%. Экспериментально выявлено, что обработка корнеплодов позволила снизить среднесуточные потери массы свеклы и сахара на 40,9 и 32,7%.
Credits
New World Encyclopedia writers and editors rewrote and completed the Wikipedia article
in accordance with New World Encyclopedia standards. This article abides by terms of the Creative Commons CC-by-sa 3.0 License (CC-by-sa), which may be used and disseminated with proper attribution. Credit is due under the terms of this license that can reference both the New World Encyclopedia contributors and the selfless volunteer contributors of the Wikimedia Foundation. To cite this article click here for a list of acceptable citing formats.The history of earlier contributions by wikipedians is accessible to researchers here:
Benzoic acid history
The history of this article since it was imported to New World Encyclopedia:
History of «Benzoic acid»
Note: Some restrictions may apply to use of individual images which are separately licensed.
Опасность
Исследования показали, что превышение концентрации бензойной кислоты пагубно влияет на жизненно важные органы и вызывает нарушение психики. Дефицит органической бензойной кислоты приводит к болезням пищеварения, депрессии. Длительный период без этого вещества приводит к нарушению обмена веществ и анемии.
В косметике вред benzoic acid в основном сводится к появлению у некоторых людей аллергии в виде крапивницы. Это означает, что у человека повышенная чувствительность к этому ингредиенту. Следует сдать тест в лаборатории, чтобы точно знать диагноз. При подтверждении его назначается диета с ограничением некоторых продуктов.
Реакции
Реакции бензойной кислоты могут протекать либо по ароматическому кольцу, либо по карбоксильной группе .
Ароматическое кольцо
Реакция электрофильного ароматического замещения будет происходить в основном в 3-м положении из-за электроноакцепторной карбоксильной группы ; т.е. бензойная кислота является .
Карбоксильная группа
Реакции, характерные для карбоновых кислот, распространяются и на бензойную кислоту.
- Бензоатные эфиры являются продуктом катализируемой кислотой реакции со спиртами .
- Амиды бензойной кислоты обычно получают из бензоилхлорида .
- Дегидратацию до бензойного ангидрида индуцируют уксусным ангидридом или пентоксидом фосфора .
- Производные кислот с высокой реакционной способностью, такие как галогенангидриды , легко получить путем смешивания с галогенирующими агентами, такими как хлориды фосфора или тионилхлорид .
- Ортоэфиры могут быть получены реакцией спиртов в кислых безводных условиях с бензонитрилом .
- Восстановление до бензальдегида и бензилового спирта возможно с использованием DIBAL-H , LiAlH 4 или боргидрида натрия .
- Декарбоксилирование до бензола можно осуществить нагреванием в хинолине в присутствии солей меди. Декарбоксилирование Хунсдикера может быть достигнуто путем нагревания соли серебра.
приложений
промышленные
-Он используется в производстве фенола окислительным декарбоксилированием бензойной кислоты при температуре 300-400 ° С. Для чего? Потому что фенол может быть использован в синтезе нейлона.
-Из него образуется гликольбензоат, химический предшественник эфира диэтиленгликоля и эфира триэтиленгликоля, вещества, используемые в качестве пластификаторов. Возможно, наиболее важным применением пластификаторов являются клеевые составы. Некоторые сложные эфиры с длинной цепью используются для смягчения пластиков, таких как ПВХ.
-Используется в качестве активатора полимеризации каучука. Кроме того, он является посредником при производстве алкидных смол, а также добавок для применений при добыче сырой нефти..
-Кроме того, он используется в производстве смол, красителей, волокон, пестицидов и в качестве модифицирующего агента для полиамидной смолы для производства полиэфира. Используется для поддержания аромата табака.
-Это предшественник бензоилхлорида, который является исходным материалом для синтеза таких соединений, как бензилбензоат, используемых в производстве искусственных ароматизаторов и репеллентов от насекомых..
лекарственный
-Это компонент мази Уитфилд, который используется для лечения кожных заболеваний, вызванных грибками, такими как стригущий лишай и стопы спортсмена. Мазь Уитфилда состоит из 6% бензойной кислоты и 3% салициловой кислоты.
-Это компонент настойки бензоина, который используется в качестве местного антисептического и ингаляционного противоотечного средства. Бензойная кислота использовалась как отхаркивающее, болеутоляющее и антисептическое средство до начала 20-го века..
-Бензойная кислота была использована в экспериментальной терапии пациентов с заболеваниями накопления остаточного азота.
Сохранение продуктов питания
Бензойная кислота и ее соли используются в консервации пищевых продуктов. Соединение способно ингибировать рост плесени, дрожжей и бактерий через pH-зависимый механизм.
Они воздействуют на эти организмы, когда их внутриклеточный pH падает до pH ниже 5, почти полностью подавляя анаэробную ферментацию глюкозы для производства бензойной кислоты. Это противомикробное действие требует рН от 2,5 до 4 для более эффективного действия.
-Он используется для консервирования таких продуктов, как фруктовые соки, газированные напитки, безалкогольные напитки с фосфорной кислотой, соленые огурцы и другие подкисленные продукты..
недостаток
Он может вступать в реакцию с аскорбиновой кислотой (витамином С), присутствующей в некоторых напитках, с образованием бензола, канцерогенного соединения. В связи с этим мы ищем другие соединения, способные сохранять пищевые продукты, которые не представляют проблемы с бензойной кислотой..
другие
-Он используется в активной упаковке, присутствуя в иономерных пленках. Из них выделяется бензойная кислота, способная ингибировать рост видов родов Penicillium и Aspergillus в микробных средах..
-Используется в качестве консерванта аромата фруктового сока и парфюма. Это также используется с этим приложением в табаке.
-Бензойная кислота используется в качестве селективного гербицида для борьбы с широколиственными и травяными сорняками в посевах сои, огурцов, дынь, арахиса и древесных декоративных растений..