Молярная концентрация
Содержание:
- Способы выражения концентрации растворов
- Установление ПДК
- Моляльность ( молярная весовая концентрация , моляльная концентрация ) [ править | править код ]
- Примеры решения задач
- Задачи для самостоятельного решения
- Мольная ( молярная ) доля [ править | править код ]
- Молярная концентрация
- Eau de toilette
- Расчет концентрации раствора
- Применимость способов выражения концентрации растворов, их свойства [ править | править код ]
- Виды химических реакций
- Таблица 2
- Определение
- Нормальная концентрация ( молярная концентрация эквивалента , « нормальность ») [ править | править код ]
- Молярность ( молярная объёмная концентрация ) [ править | править код ]
- Растворимость. Коэффициент растворимости
- Массовая доля в химии — что это за параметр
- Качественное описание
- Массовая доля в химии — что это за параметр
Способы выражения концентрации растворов
Существуют различные способы выражения концентрации растворов.
Массовая доля ω компонента раствора определяется как отношение массы данного компонента Х, содержащегося в данной массе раствора к массе всего раствора m. Массовая доля – безразмерная величина, её выражают в долях от единицы:
ωр.в. = mр.в./mр-ра(0 < ωр.в. < 1) (1)
Массовый процент представляет собой массовую долю, умноженную на 100:
ω(Х) = m(Х)/m · 100% (0% < ω(Х) < 100%) (2)
где ω(X) – массовая доля компонента раствора X; m(X) – масса компонента раствора X; m – общая масса раствора.
Мольная доля χ компонента раствора равна отношению количества вещества данного компонента X к суммарному количеству вещества всех компонентов в растворе.
Для бинарного раствора, состоящего из растворённого вещества Х и растворителя (например, Н2О), мольная доля растворённого вещества равна:
χ(X) = n(X)/(n(X) + n(H2O)) (3)
Мольный процент представляет мольную долю, умноженную на 100:
χ(X), % = (χ(X)·100)% (4)
Объёмная доля φ компонента раствора определяется как отношение объёма данного компонента Х к общему объёму раствора V. Объёмная доля – безразмерная величина, её выражают в долях от единицы:
φ(Х) = V(Х)/V (0 < φ(Х) < 1) (5)
Объёмный процент представляет собой объёмную долю, умноженную на 100.
φ(X), % = (φ(X)·100)%
Молярность (молярная концентрация) C или Cм определяется как отношение количества растворённого вещества X, моль к объёму раствора V, л:
Cм(Х) = n(Х)/V (6)
Основной единицей молярности является моль/л или М. Пример записи молярной концентрации: Cм(H2SO4) = 0,8 моль/л или 0,8М.
Нормальность Сн определяется как отношение количества эквивалентов растворённого вещества X к объёму раствора V:
Cн(Х) = nэкв.(Х)/V (7)
Основной единицей нормальности является моль-экв/л. Пример записи нормальной концентрации: Сн(H2SO4) = 0,8 моль-экв/л или 0,8н.
Титр Т показывает, сколько граммов растворённого вещества X содержится в 1 мл или в 1 см3 раствора:
T(Х) = m(Х)/V (8)
где m(X) – масса растворённого вещества X, V – объём раствора в мл.
Моляльность раствора μ показывает количество растворённого вещества X в 1 кг растворителя:
μ(Х) = n(Х)/mр-ля (9)
где n(X) – число моль растворённого вещества X, mр-ля – масса растворителя в кг.
Мольное (массовое и объёмное) отношение – это отношение количеств (масс и объёмов соответственно) компонентов в растворе.
Необходимо иметь ввиду, что нормальность Сн всегда больше или равна молярности См. Связь между ними описывается выражением:
См = Сн · f(Х) (10)
Для получения навыков пересчёта молярности в нормальность и наоборот рассмотрим табл. 1. В этой таблице приведены значения молярности См, которые необходимо пересчитать в нормальность Сн и величины нормальности Сн, которые следует пересчитать в молярность См.
Пересчёт осуществляем по уравнению (10). При этом нормальность раствора находим по уравнению:
Сн = См/f(Х) (11)
Результаты расчётов приведены в табл. 2.
Таблица 1. К определению молярности и нормальности растворов
| Тип химического превращения | См | Сн | Сн | См |
| Реакции обмена | 0,2 M Na2SO4 | ? | 6 н FeCl3 | ? |
| 1,5 M Fe2(SO4)3 | ? | 0,1 н Ва(ОН)2 | ? | |
| Реакции окисления-восстановления |
0,05 М KMnO4
в кислой среде |
? |
0,03 М KMnO4
в нейтральной среде |
? |
Таблица 2
Значения молярности и нормальности растворов
| Тип химического превращения | См | Сн | Сн | См |
| Реакции обмена | 0,2M Ma2SO4 | 0,4н | 6н FeCl3 | 2М |
| 1,5M Fe2(SO4)3 | 9н | 0,1н Ва(ОН)2 | 0,05М | |
| Реакции окисления-восстановления | 0,05М KMnO4 в кислой среде | 0,25н |
0,03М KMnO4
в нейтральной среде |
0,01М |
Между объёмами V и нормальностями Сн реагирующих веществ существует соотношение:
V1 Сн,1 =V2 Сн,2 (12)
Установление ПДК
Первоначально предельно допустимая концентрация веществ в среде устанавливались исходя из «отсутствия практического влияния на здоровье человека». Однако этот критерий оказался слишком неопределенным и недостоверным, так как он не учитывал генетических и долгосрочных последствий негативного воздействия. Так, стало ясно, что некоторые канцерогены (т.е. вещества, вызывающие рак), опасны при любых концентрациях, а их действие проявляется спустя много лет. Подобным действием отличаются, к примеру, анилиновые красители, которые являются облигатными канцерогенами рака мочевого пузыря, то есть в обязательном порядке провоцируют его появление. Кратковременные и эпизодические контакты с ними не опасны, однако при большом стаже работы с этими веществами с большой вероятностью возможно развитие опухоли; рак данной локализации считается профессиональным заболеванием для людей, трудящихся на производстве красок, а также маляров, работников лабораторий и т.д.
В других случаях накопление вещества в пищевых цепях превращает его вполне безобидные для человека концентрации в природной среде в довольно высокие и вредные в продуктах питания. К примеру, в некоторых географических областях употребление в пищу раков и глубоководной рыбы (сом) потенциально опасно, так как они питаются органическими остатками со дна и водорослями, накапливающими токсины, которые выпадают там в осадок. Кроме того, токсические соединения, практически безвредные для человека при наблюдаемых концентрациях, наносят громадный ущерб природной среде, поэтому нормы ПДК постоянно пересматриваются в сторону их уменьшения.
Моляльность ( молярная весовая концентрация , моляльная концентрация ) [ править | править код ]
Моляльная концентрация (моляльность, молярная весовая концентрация) — количество растворённого вещества (число моль) в 1000 г растворителя. Измеряется в молях на кг, также распространено выражение в «моляльности». Так, раствор с концентрацией 0,5 моль/кг называют 0,5-мольным.
m B = n B m A <displaystyle >>= <frac >> >>> ,
- n B <displaystyle n_<mathrm >>— количество растворённого вещества, моль;
- m A <displaystyle m_<mathrm >>— масса растворителя, кг.
Следует обратить особое внимание, что, несмотря на сходство названий, моля р ная концентрация и моля л ьность — величины различные. Прежде всего, в отличие от молярной концентрации, при выражении концентрации в моляльности расчёт ведут на массу растворителя, а не на объём раствора
Моляльность, в отличие от молярной концентрации, не зависит от температуры.
Примеры решения задач
Задача 1. Рассчитайте молярность, нормальность, моляльность, титр, мольную долю и мольное отношение для 40 мас.% раствора серной кислоты, если плотность этого раствора равна 1,303 г/см3.
Решение.
Масса 1 литра раствора равна М = 1000·1,303 = 1303,0 г.
Масса серной кислоты в этом растворе: m = 1303·0,4 = 521,2 г.
Молярность раствора См = 521,2/98 = 5,32 М.
Нормальность раствора Сн = 5,32/(1/2) = 10,64 н.
Титр раствора Т = 521,2/1000 = 0,5212 г/см3.
Моляльность μ = 5,32/(1,303 – 0,5212) = 6,8 моль/кг воды.
Обратите внимание на то, что в концентрированных растворах моляльность (μ) всегда больше молярности (См). В разбавленных растворах наоборот
Масса воды в растворе: m = 1303,0 – 521,2 = 781,8 г.
Количество вещества воды: n = 781,8/18 = 43,43 моль.
Мольная доля серной кислоты: χ = 5,32/(5,32+43,43) = 0,109. Мольная доля воды равна 1– 0,109 = 0,891.
Мольное отношение равно 5,32/43,43 = 0,1225.
Задача 2. Определите объём 70 мас.% раствора серной кислоты (r = 1,611 г/см3), который потребуется для приготовления 2 л 0,1 н раствора этой кислоты.
Решение.
2 л 0,1н раствора серной кислоты содержат 0,2 моль-экв, т.е. 0,1 моль или 9,8 г.
Масса 70%-го раствора кислоты m = 9,8/0,7 = 14 г.
Объём раствора кислоты V = 14/1,611 = 8,69 мл.
Задача 3. В 5 л воды растворили 100 л аммиака (н.у.). Рассчитать массовую долю и молярную концентрацию NH3 в полученном растворе, если его плотность равна 0,992 г/см3.
Решение.
Масса 100 л аммиака (н.у.) m = 17·100/22,4 = 75,9 г.
Масса раствора m = 5000 + 75,9 = 5075,9 г.
Массовая доля NH3 равна 75,9/5075,9 = 0,0149 или 1,49 %.
Количество вещества NH3 равно 100/22,4 = 4,46 моль.
Объём раствора V = 5,0759/0,992 = 5,12 л.
Молярность раствора См = 4,46/5,1168 = 0,872 моль/л.
Задача 4. Сколько мл 0,1М раствора ортофосфорной кислоты потребуется для нейтрализации 10 мл 0,3М раствора гидроксида бария?
Решение.
Переводим молярность в нормальность:
0,1 М Н3РО4 0,3 н; 0,3 М Ва(ОН)2 0,6 н.
Используя выражение (12), получаем: V(H3P04)=10·0,6/0,3 = 20 мл.
Задача 5. Какой объем, мл 2 и 14 мас.% растворов NaCl потребуется для приготовления 150 мл 6,2 мас.% раствора хлорида натрия?
Плотности растворов NaCl:
| С, мас.% | 2 | 6 | 7 | 14 |
| ρ, г/см3 | 2,012 | 1,041 | 1,049 | 1,101 |
Решение.
Методом интерполяции рассчитываем плотность 6,2 мас.% раствора NaCl:
6,2% =6% + 0,2(7% —6% )/(7 – 6) = 1,0410 + 0,0016 = 1,0426 г/см3.
Определяем массу раствора: m = 150·1,0426 = 156,39 г.
Находим массу NaCl в этом растворе: m = 156,39·0,062 = 9,70 г.
Для расчёта объёмов 2 мас.% раствора (V1) и 14 мас.% раствора (V2) составляем два уравнения с двумя неизвестными (баланс по массе раствора и по массе хлорида натрия):
156,39 = V1 1,012 + V2 1,101 ,
9,70 = V1·1,012·0,02 + V2·1,101·0,14 .
Решение системы этих двух уравнений дает V1 =100,45 мл и V2 = 49,71 мл.
Задачи для самостоятельного решения
3.1. Рассчитайте нормальность 2 М раствора сульфата железа (III), взаимодействующего со щёлочью в водном растворе.
12 н.
3.2. Определите молярность 0,2 н раствора сульфата магния, взаимодействующего с ортофосфатом натрия в водном растворе.
0,1 M.
3.3. Рассчитайте нормальность 0,02 М раствора KMnO4, взаимодействующего с восстановителем в нейтральной среде.
0,06 н.
3.4. Определите молярность 0,1 н раствора KMnO4, взаимодействующего с восстановителем в кислой среде.
0,02 M.
3.5. Рассчитать нормальность 0,2 М раствора K2Cr2O7, взаимодействующего с восстановителем в кислой среде.
1,2 M.
3.6. 15 г CuSO4·5H2O растворили в 200 г 6 мас.% раствора CuSO4. Чему равна массовая доля сульфата меди, а также молярность, моляльность и титр полученного раствора, если его плотность составляет 1,107 г/мл?
0,1; 0,695М; 0,698 моль/кг; 0,111 г/мл.
3.7. При выпаривании 400 мл 12 мас.% раствора KNO3 (плотность раствора 1,076 г/мл) получили 2М раствор нитрата калия. Определить объём полученного раствора, его нормальную концентрацию и титр.
255 мл; 2 н; 0,203 г/мл.
3.8. В 3 л воды растворили 67,2 л хлороводорода, измеренного при нормальных условиях. Плотность полученного раствора равна 1,016 г/мл. Вычислить массовую, мольную долю растворённого вещества и мольное отношение растворённого вещества и воды в приготовленном растворе.
0,035; 0,0177; 1:55,6.
3.9. Сколько граммов NaCl надо добавить к 250 г 6 мас.% раствору NaCl, чтобы приготовить 500 мл раствора хлорида натрия, содержащего 16 мас.% NaCl? Плотность полученного раствора составляет 1,116 г/мл. Определить молярную концентрацию и титр полученного раствора.
74,28 г; 3,05 М; 0,179 г/мл.
3.10. Определить массу воды, в которой следует растворить 26 г ВaCl2·2H2O для получения 0,55М раствора ВaCl2 (плотность раствора 1,092 г/мл). Вычислить титр и моляльность полученного раствора.
192,4 г; 0,111 г/мл; 0,56 моль/кг.
Мольная ( молярная ) доля [ править | править код ]
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы. ИЮПАК рекомендует обозначать мольную долю буквой x <displaystyle x> (а для газов — y <displaystyle y> ) , также в литературе встречаются обозначения χ <displaystyle chi > , X <displaystyle X> .
x B = n B ∑ n i <displaystyle x_<mathrm >= <frac >><sum n_>>> ,
Мольная доля может использоваться, например, для количественного описания уровня загрязнений в воздухе, при этом её часто выражают в частях на миллион (ppm — от англ. parts per million ). Однако, как и в случае с другими безразмерными величинами, во избежание путаницы, следует указывать величину, к которой относится указанное значение.
Молярная концентрация
М¾Ã»ÃÂÃÂýðàúþýÃÂõýÃÂÃÂðÃÂøàâ úþûøÃÂõÃÂÃÂòþ òõÃÂõÃÂÃÂòð (ò üþûÃÂÃÂ) ò þñÃÂõüõ ÃÂðÃÂÃÂòþÃÂð. ÃÂþûøÃÂõÃÂÃÂòþ ÃÂðÃÂÃÂòþÃÂõýýþóþ òõÃÂõÃÂÃÂòð (ò üþûÃÂÃÂ) òÃÂÃÂðöðõÃÂÃÂàúðú üðÃÂÃÂð òõÃÂõÃÂÃÂòð (ò óÃÂðüüðÃÂ), ôõûõýýðàýð üþûÃÂÃÂýÃÂàüðÃÂÃÂà(ó/üþûÃÂ).
÷=mxM\eta =\frac{m_{x}}{M}÷=MmxâÂÂâÂÂ
ÃÂþûÃÂÃÂýðàúþýÃÂõýÃÂÃÂðÃÂøàòÃÂÃÂðöðõÃÂÃÂàò ÃÂþÃÂüÃÂûõ:
Cx=÷V=÷=mxMÃÂVC_{x} = \frac{\eta }{V} = \eta =\frac{m_{x}}{M}\times VCxâÂÂ=V÷âÂÂ=÷=MmxâÂÂâÂÂÃÂV
Eau de toilette
Сегодня EDT – один из самых популярных типов изделий. Покупателей больше всего привлекает относительно низкая цена. Нужно отметить, что это нестойкая продукция. Как правило, держится она в пределах трех часов. Ответ на вопрос: «Что это такое – Eau de toilette (EDT) в парфюмерии» дает его концентрация – она составляет не более 10%. Ей и определяется небольшая стойкость. Подобной водичкой можно душиться не один раз за сутки. Купив маленькую бутылочку и положив ее в сумочку, вы сможете пользоваться ею по мере необходимости. Благодаря своей ненасыщенности и легкости хорошо подходит даже в знойные летние дни.
Покупая данный вид парфюмерии, немногие из нас задумываются о его происхождении. А корни уходят далеко в античную Грецию и Египет, когда душистым раствором пользовались, чтобы наполнить помещение приятным благоуханием. Однако официальной версией создания данного продукта считается случай, когда Наполеона Бонапарта отправили в ссылку на остров St. Helena. Во время заточения у полководца Франции закончился одеколон. Тогда бывший император создал свою ароматную жидкость, главным компонентом которой был бергамот.
Расчет концентрации раствора
Молярная концентрация
Концентрацию можно выражать по разному, но наиболее распространенный способ — указание его молярности. Молярная концентрация (молярность) — это число молей растворенного вещества в 1 литре раствора. Единица молярности обозначается символом M. Например два моля соляной кислоты на 1 литр раствора обозначается 2 М HCl. Кстати, если на 1 литр раствора приходится 1 моль растворенного вещества, тогда раствор называется одномолярным. Молярная концентрация раствора обозначается различными символами:
cx, Смx, , где x — растворенное вещество
Формула для вычисления молярной концентрации (молярности):
См = n/V, моль/л
где n — количество растворенного вещества в молях, V — объем раствора в литрах.
Пару слов о технике приготовления растворов нужной молярности. Очевидно, что если добавить к одному литру растворителя 1 моль вещества, общий объем раствора будет чуть больше одного литра, и потому будет ошибкой считать полученный раствор одномолярным. Чтобы этого избежать, первым делом добавляем вещество, а только потом доливаем воду, пока суммарный объем раствора не будет равным 1 л. Полезно будет запомнить приближенное правило аддитивности объемов, которое гласит, что объем раствора приближенно равен сумме объемов растворителя и растворенного вещества. Растворы многих солей приближенно подчиняются данному правилу.
Пример 1. Химичка дала задание растворить в литре воды 264 г сульфата аммония (NH4)2SO4, а затем вычислить молярность полученного раствора и его объем, основываясь на предположении об аддитивности объемов. Плотность сульфата аммония равна 1,76 г/мл.
Решение:
Определим объем (NH4)2SO4 до растворения:
264 г / 1,76 г/мл = 150 мл = 0,150 л
Пользуясь правилом аддитивности объемов, найдем окончательный объем раствора:
1,000 л + 0,150 л = 1,150 л
Число молей растворенного сульфата аммония равно:
264 г / 132 г/моль = 2,00 моля (NH4)2SO4
Завершающий шаг! Молярность раствора равна:
2,000 / 1,150 л = 1,74 моль/л, т.е 1,74 М (NH4)2SO4
Приближенным правилом аддитивности объемов можно пользоваться только для грубой предварительной оценки молярности раствора. Например, в примере 1, объем полученного раствора на самом деле имеет молярную концентрацию равную 1,8 М, т.е погрешность наших расчетов составляет 3,3%.
Моляльная концентрация
Наряду с молярностью, химики используют моляльность, или моляльную концентрацию, в основе которой учитывается количество использованного растворителя, а не количество образующегося раствора. Моляльная концентрация — это число молей растворенного вещества в 1 кг растворителя (а не раствора!). Моляльность выражается в моль/кг и обозначается маленькой буквой m. Формула для вычисления моляльной концентрации:
m = n/m
где n — количество растворенного вещества в молях, m — масса растворителя в кг
Для справки отметим, что 1 л воды = 1 кг воды, и еще, 1 г/мл = 1 кг/л.
Пример 2. Химичка попросила определить моляльность раствора, полученного при растворении 5 г уксусной кислоты C2H4O2 в 1 л этанола. Плотность этанола равна 0,789 г/мл.
Решение:
Число молей уксусной кислоты в 5 г равно:
5,00 г / 60,05 г/моль = 0,833 моля C2H4O2
Масса 1 л этанола равна:
1,000 л × 0,789 кг/л = 0,789 кг этанола
Последний этап. Найдем моляльность полученного раствора:
0,833 моля / 0,789 кг растворителя = 0,106 моль/кг
Единица моляльности обозначается Мл, поэтому ответ также можно записать 0,106 Мл.
Применимость способов выражения концентрации растворов, их свойства [ править | править код ]
В связи с тем, что моляльность, массовая доля, мольная доля не включают в себя значения объёмов, концентрация таких растворов остаётся неизменной при изменении температуры. Молярность, объёмная доля, титр, нормальность изменяются при изменении температуры, так как при этом изменяется плотность растворов. Именно моляльность используется в формулах повышения температуры кипения и понижения температуры замерзания растворов.
Разные виды выражения концентрации растворов применяются в разных сферах деятельности, в соответствии с удобством применения и приготовления растворов заданных концентраций. Так, титр раствора удобен в аналитической химии для волюмометрии (титриметрического анализа) и т. п.
Виды химических реакций
Вещества вступают в реакции по-разному, можно выделить четыре наиболее частых варианта:
.jpg)
Соединение. Два или несколько реагентов образуют один продукт. В реакцию могут вступать как простые вещества, так и сложные. Например, простые вещества водород и кислород взаимодействуют и образуют сложное — воду:
.jpg)
Сложное вещество негашёная известь соединяется с водой, и образуется новое сложное вещество — гашёная известь:
.jpg)
Разложение. Обратный процесс: одно вещество распадается на несколько более простых. Например, если нагреть известняк, получаются негашёная известь и углекислый газ:

Стрелка вверх означает, что образовался газ. Он улетучивается и больше не участвует в реакции.
Замещение. В реакции участвуют два вещества — простое и сложное. Если атомы химического элемента в простом веществе более активны, они замещают атомы одного из менее активных химических элементов в составе сложного вещества.
В примере атомы цинка замещают атомы водорода в составе хлороводорода, и образуется хлорид цинка:

Обмен. Два сложных вещества обмениваются составными частями, в результате получаются два новых сложных вещества. В такой реакции обязательно образуется вода, газ или осадок.
.jpg)
Стрелка вниз означает, что вещество выпало в осадок, поскольку оно нерастворимо.
Таблица 2
| Показатель | х 109/л | % |
|---|---|---|
| Палочкоядерные нейтрофилы | 0,04-0,3 | 1-6 |
| Сегментоядерные нейтрофилы | 2-5,5 | 45-72 |
| Базофилы | до 0,065 | до 1 |
| Эозинофилы | 0,02-0,3 | 0,5-5 |
| Лимфоциты | 1,2-3 | 19-37 |
| Моноциты | 0,09-0,6 | 3-11 |
В результатах общего анализа крови (Таблица 1) приведено множество показателей. Рассмотрим основные из них:
- RBC – общее количество красных кровяных телец (эритроцитов). Патологическое увеличение этих клеток связано с нарушением кроветворения. Снижение эритроцитов, как правило, является следствием анемии, гемолиза и кровопотерь.
- HGB – гемоглобин, который представляет собой белок, содержащий железо. Он транспортирует кислород к тканям, а углекислый газ – от них, а также поддерживает кислотно-щелочное равновесие. Снижение гемоглобина чаще всего возникает вследствие анемии.
- HCT – гематокрит. Он определяется как соотношение между эритроцитами, которые осели на дно после взятия анализа, и общим объемом крови. Повышение данного показателя свидетельствует о полиурии, эритроцитозе или эритремии. Снижение уровня гематокрита бывает при анемии и увеличении объема циркулирующей крови.
- PLT – тромбоциты. Эти клетки отвечают за свертываемость крови. Если их количество снижается, то причиной могут быть вирусные заболевания, поражения костного мозга, инфекции бактериального характера и другие патологии. Рост числа тромбоцитов вызван самыми разнообразными недугами: от болезней суставов до раковых опухолей.
- ЦП – цветовой показатель. Он определяет насыщение эритроцитов гемоглобином. Если оно недостаточное, то это может свидетельствовать о железодефицитной анемии, малокровии или отравлениях свинцом. Когда ЦП поднимается выше нормы, то причиной является онкология, полипоз желудка и дефицит витаминов В9 и В12.
- Эритроцитарные индексы:
- MCV – средний объем эритроцитов, служащий для определения водно-солевого баланса и типа анемии;
- RDW – степень разнообразия эритроцитов, которая определяет, насколько клетки отличаются друг от друга по объему;
- MCH – среднее содержание гемоглобина в эритроците; этот критерий считается аналогом цветового показателя;
- MCHC – средняя концентрация и содержание гемоглобина в красных клетках крови; этот показатель рассчитывается с учетом уровня гематокрита и гемоглобина.
- ESR – скорость оседания эритроцитов. Этот показатель позволяет определить самые разнообразные патологии. В больших количествах он наблюдается при онкологических заболеваниях, инфекционных патологиях, воспалительных процессах и т.д. Снижение скорости оседания эритроцитов часто бывает следствием нарушения кровообращения, появления анафилактического шока и развития сердечно-сосудистых болезней.
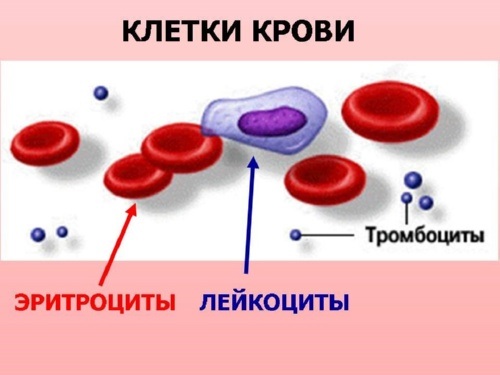 Теперь перейдем к лейкоцитарной формуле (Таблица 2). Она определяет процентное соотношение различных видов лейкоцитов в крови, то есть относительное содержание каждого типа белых клеток. Для чего нужна эта формула? Она очень важна, поскольку при любых изменениях в организме процентное содержание определенных видов белых клеток в крови уменьшается или увеличивается. Это связано со снижением или ростом других типов. По информации, полученной вследствие лейкоцитарной формулы, можно судить о течении той или иной патологии, появлении осложнений, а также более точно прогнозировать исход заболевания.
Теперь перейдем к лейкоцитарной формуле (Таблица 2). Она определяет процентное соотношение различных видов лейкоцитов в крови, то есть относительное содержание каждого типа белых клеток. Для чего нужна эта формула? Она очень важна, поскольку при любых изменениях в организме процентное содержание определенных видов белых клеток в крови уменьшается или увеличивается. Это связано со снижением или ростом других типов. По информации, полученной вследствие лейкоцитарной формулы, можно судить о течении той или иной патологии, появлении осложнений, а также более точно прогнозировать исход заболевания.
Определение
Молярная концентрация или молярность чаще всего выражается в молях растворенного вещества на литр раствора . Для использования в более широких сферах применения он определяется как количество растворенного вещества на единицу объема раствора или на единицу объема, доступного для видов, представленное строчными буквами :
c{\ displaystyle c}
- cзнак равнопVзнак равноNNАVзнак равноCNА.{\ displaystyle c = {\ frac {n} {V}} = {\ frac {N} {N _ {\ text {A}} \, V}} = {\ frac {C} {N _ {\ text {A }}}}.}
Здесь — количество растворенного вещества в молях, — это количество составляющих частиц, присутствующих в объеме (в литрах) раствора, и — это постоянная Авогадро , с 24 января 2021 года определяемая как точноп{\ displaystyle n}N{\ displaystyle N}V{\ displaystyle V}NА{\ displaystyle N _ {\ text {A}}}6.022 140 76 × 10 23 моль -1 . Отношение — это числовая плотность .
NV{\ displaystyle {\ frac {N} {V}}} C{\ displaystyle C}
В термодинамике использование молярной концентрации часто неудобно, поскольку объем большинства растворов незначительно зависит от температуры из-за теплового расширения . Эта проблема обычно решается введением поправочных коэффициентов на температуру или использованием не зависящего от температуры показателя концентрации, например моляльности .
Обратная величина представляет разбавление (объем) , который может появиться в Оствальда закон разбавления .
- Формальность или аналитическая концентрация
Если молекулярный объект диссоциирует в растворе, концентрация относится к исходной химической формуле в растворе, молярная концентрация иногда называется формальной концентрацией или формальностью ( F A ) или аналитической концентрацией ( c A ). Например, если раствор карбоната натрия (Na 2 CO 3 ) имеет формальную концентрацию c (Na 2 CO 3 ) = 1 моль / л, молярные концентрации составляют c (Na + ) = 2 моль / л и c (CO2- 3) = 1 моль / л, поскольку соль диссоциирует на эти ионы.
Нормальная концентрация ( молярная концентрация эквивалента , « нормальность ») [ править | править код ]
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре смеси. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов). Для записи концентрации таких растворов используют сокращения «н» или «N». Например, раствор, содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.
c ( f e q B ) = c ( ( 1 / z ) B ) = z ⋅ c B = z ⋅ n B V = 1 f e q ⋅ n B V
mathrm <ig )>=zcdot c_ <mathrm >=zcdot <frac >>>=<frac <1>>>cdot <frac >>>> ,
- n B <displaystyle n_<mathrm >>— количество вещества компонента, моль;
- V <displaystyle V>— общий объём смеси, литров;
- z <displaystyle z>— число эквивалентности (фактор эквивалентности f e q = 1 / z <displaystyle f_=1/z>).
Нормальная концентрация может отличаться в зависимости от реакции, в которой участвует вещество. Например, одномолярный раствор H2SO4 будет однонормальным, если он предназначается для реакции со щёлочью с образованием гидросульфата калия KHSO4, и двухнормальным в реакции с образованием K2SO4.
Молярность ( молярная объёмная концентрация ) [ править | править код ]
Молярная концентрация (молярность, мольность ) — количество вещества (число молей) компонента в единице объёма смеси. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л. Также используют выражение «в молярности». Возможно другое обозначение молярной концентрации, которое принято обозначать М. Так, раствор с концентрацией 0,5 моль/л называют 0,5-молярным, записывают «0,5 M».
По рекомендации ИЮПАК, обозначается буквой c <displaystyle c> или <displaystyle > , где B — вещество, концентрация которого указывается.
Примечание: После числа пишут «моль», подобно тому, как после числа пишут «см», «кг» и т. п., не склоняя по падежам.
c B = n B V <displaystyle >>= <frac >>>> ,
- n B <displaystyle n_<mathrm >>— количество вещества компонента, моль;
- V — общий объём смеси, л.
Растворимость. Коэффициент растворимости
Растворение –
процесс образования раствора из компонентов. Растворение
представляет собой обратимый процесс, который при неизменности
внешних условий достигает состояния равновесия.
Раствор, находящийся в состоянии равновесия с
избытком растворенного вещества, называется
насыщенным.
Концентрация насыщенного
раствора – это равновесная концентрация, зависящая от природы
растворителя, растворенного вещества и не зависящая от того, как
раствор был приготовлен.
Способность
вещества растворяться в определенном растворителе называется
растворимостью этого вещества в данном растворителе.
Чаще всего характеризуют способность вещества
растворяться в воде и под растворимостью вещества понимают
растворимость в воде. Количесвенно растворимость вещества при
определенных условиях может быть связана с концентрацией его
насыщенного при данных условиях раствора, т.к. это –
воспроизводящаяся величина. Принятыми способами выражения
растворимости вещества в воде (или другом растворителе) является
коэффициент растворимости.
Коэффициент
растворимости показывает, какую массу вещества надо растворить
при определенных условиях в 100 г воды (или в 1 литре воды),
чтобы получить насыщенный при данных условиях раствор. При
записи коэффициента растворимости обязательно указывается
вещество, растворитель и внешние условия (для веществ в твердом
состоянии обычно в качестве внешних условий указывают только
температуру), например:
растворимость
KNO3при 20oС равна 25 г в 100 г воды,
или
растворимость KNO3 в воде
при 20oС равна 250 г/ л.
По
электропроводности растворов их делят на растворы электролитов –
эти растворы проводят электрический ток – и растворы
неэлектролитов, не обладающие электропроводностью.
Массовая доля в химии — что это за параметр
Другими словами, массовая доля части в целом расценивается как ее отношение к сумме масс всех, составляющих эту смесь, компонентов.
Для обозначения данного параметра введен символ ω (омега). ω может иметь процентное выражение либо измерятся в долях единицы.
Любая смесь (жидкая, твердая, газообразная) состоит из компонентов, сумма масс которых равна массе смеси. Их количество в единице объема конечного вещества различно. При приготовлении составов используются установленные рецептуры с соотношением компонентов. В смесях природного происхождения состав зависит от условий внешней среды.
Например, атмосферный воздух населенного пункта, имеющего производственный комбинат, будет различным по составу над жилой зоной и в радиусе выбросов в атмосферу производственных газов. Каждый из этих газов составляет в выбросах определенный процент. Зная его, а также общую массу выбросов, можно определить массу каждого компонента воздушной смеси и сравнить ее с аналогичными параметрами воздушных масс над жилой зоной.
На таком же принципе основаны экологические исследования состава вод открытых водоемов, сплавов, концентратов в пищевой промышленности, фармацевтических препаратов и т.д.
Понятие «массовая доля» хоть и является аналогичным понятиям «объемная доля» или «молярность», но отлично тем, что при ее определении используются именно массы компонентов и смеси в целом.
Умение определять массовую долю важно, например, если нужно рассчитать, сколько бензина можно получить из нефти определенной массы или какое количество каждого компонента взять для приготовления синтетических материалов. От массовых долей компонентов раствора зависит его плотность, что очень важно в химическом производстве
Плотность вещества рассчитывают на основании формулы:
От массовых долей компонентов раствора зависит его плотность, что очень важно в химическом производстве. Плотность вещества рассчитывают на основании формулы:. m вещества = ρ вещества ×V вещества
m вещества = ρ вещества ×V вещества
Исходя из этой формулы, если плотность воды 1 г/мл, то 1 мл воды будет иметь массу 1 г.
Качественное описание
 Эти стекла, содержащие красный краситель, демонстрируют качественные изменения концентрации. Растворы слева более разбавленные по сравнению с более концентрированными растворами справа.
Эти стекла, содержащие красный краситель, демонстрируют качественные изменения концентрации. Растворы слева более разбавленные по сравнению с более концентрированными растворами справа.
Часто на неформальном, нетехническом языке, концентрация описывается качественным образом с использованием таких прилагательных, как «разбавленный» для растворов относительно низкой концентрации и «концентрированный» для растворов относительно высокой концентрации. Чтобы сконцентрировать раствор, нужно добавить больше растворенного вещества (например, спирта) или уменьшить количество растворителя (например, воды). Напротив, чтобы разбавить раствор, нужно добавить больше растворителя или уменьшить количество растворенного вещества. Если два вещества не смешиваются , существует концентрация, при которой растворенное вещество не растворяется в растворе. В этот момент говорят, что раствор насыщен . Если к насыщенному раствору добавить дополнительное растворенное вещество, оно не будет растворяться, за исключением определенных обстоятельств, когда может произойти перенасыщение . Вместо этого произойдет , что приведет к сосуществованию фаз, полностью разделенных или смешанных в виде суспензии . Точка насыщения зависит от многих переменных, таких как температура окружающей среды и точная химическая природа растворителя и растворенного вещества.
Концентрации часто называют уровни , отражающие ментальную схему из уровней на вертикальной оси в виде графика , который может быть высокой или низкой (например, «высокие сывороточные уровни билирубина» являются концентрации билирубина в сыворотке крови , которые больше , ).
Массовая доля в химии — что это за параметр
Другими словами, массовая доля части в целом расценивается как ее отношение к сумме масс всех, составляющих эту смесь, компонентов.
Для обозначения данного параметра введен символ ω (омега). ω может иметь процентное выражение либо измерятся в долях единицы.
Любая смесь (жидкая, твердая, газообразная) состоит из компонентов, сумма масс которых равна массе смеси. Их количество в единице объема конечного вещества различно. При приготовлении составов используются установленные рецептуры с соотношением компонентов. В смесях природного происхождения состав зависит от условий внешней среды.
Например, атмосферный воздух населенного пункта, имеющего производственный комбинат, будет различным по составу над жилой зоной и в радиусе выбросов в атмосферу производственных газов. Каждый из этих газов составляет в выбросах определенный процент. Зная его, а также общую массу выбросов, можно определить массу каждого компонента воздушной смеси и сравнить ее с аналогичными параметрами воздушных масс над жилой зоной.
На таком же принципе основаны экологические исследования состава вод открытых водоемов, сплавов, концентратов в пищевой промышленности, фармацевтических препаратов и т.д.
Понятие «массовая доля» хоть и является аналогичным понятиям «объемная доля» или «молярность», но отлично тем, что при ее определении используются именно массы компонентов и смеси в целом.
Умение определять массовую долю важно, например, если нужно рассчитать, сколько бензина можно получить из нефти определенной массы или какое количество каждого компонента взять для приготовления синтетических материалов. От массовых долей компонентов раствора зависит его плотность, что очень важно в химическом производстве
Плотность вещества рассчитывают на основании формулы:
От массовых долей компонентов раствора зависит его плотность, что очень важно в химическом производстве. Плотность вещества рассчитывают на основании формулы:. m вещества = ρ вещества × V вещества
m вещества = ρ вещества × V вещества
Исходя из этой формулы, если плотность воды 1 г/мл, то 1 мл воды будет иметь массу 1 г.







